您現在的位:首頁 > 新聞動態 > 公司新聞 > 公司新聞
2018諾貝爾化學獎解析: 當KAPA插上“進化”的翅膀,我們的征途便是星辰大海
來源:東岱科學器材日期:2018-10-09 14:50:00瀏覽次數:次

圖片來源于瑞典皇家科學院
2018 年的諾貝爾化學獎授予了弗朗西斯·阿諾德(Frances Arnold),喬治·史密斯(George Smith)和格雷格·保羅·溫特(Gregory Paul Winter),表彰他們在酶的定向進化,以及多肽與抗體的噬菌體展示技術領域的貢獻。
雖然化學獎授予了3個在生物學領域有突出貢獻的科學家這事兒挺稀奇的,但是這種跨界卻也無可厚非,表面上看上去毫無關聯,但內核卻息息相通,這些創新技術的背后都是亙古不變的生物生存法則——進化,而進化的本質在化學層面上就是基因變異,進而導致蛋白質在分子層面上發生改變,產生新的物種,造就豐富多彩的世界。成功者上位曰為“進化”,失敗者則出局淹沒在浩瀚的歷史長河中,這就是自然法則。三位科學家的偉大之處就是巧妙的利用了自然法則,不僅向自然學習,更超越了自然,應用這個法則來造福蕓蕓眾生。其中,Frances發明的“定向進化”(Directed Evolution)技術通過對野生酶進行基因工程改造,實現了酶的定向進化,可高效獲得符合不同應用場景所需的酶;而George和Gregory的主要貢獻是開發了一種叫做“噬菌體展示”(Phage Display)的技術,利用噬菌體來表達感興趣的基因,進而對這些蛋白質進行高效篩選和進化,用于更好的開發抗體藥物。
你可能會覺得這些技術聽上去都挺高大上的,但和我們的生活有什么關聯呢?遠的不說,今天就來詳細解析一下“定向進化”技術及其在新一代測序技術(NGS)上的小應用。
眾所周知,當今醫學技術已經跨入了“精準醫學”(Precision Medicine)時代,和“經驗醫學”(Empirical Medicine,第一代)及“循證醫學”(Evidence-based Medicine,第二代)所不同的是,精準醫學非常強調個體化的精準診斷和治療,同病可異治(Umbrella Trial),異病也可同治(Basket Trial),前者追尋相似的疾病表征下是否有不同的基因驅動機制以及因人而異的治療策略,使患者得到更適合的治療;后者則關注不同疾病背后是否有相同的基因驅動機制以及有沒有現有的治療手段可以應用,讓患者得到更及時的治療。但無論是同病異治還是異病同治,都離不開NGS技術的崛起和進步,毫不夸張的說,沒有NGS技術就沒有精準醫學。
同樣,NGS技術也離不開幾個核心的基礎技術,高保真聚合酶就是其中的“關鍵先生”之一,而我們今天的主角——定向進化——就是獲得高性能高保真聚合酶的技術保障,業內目前普遍認可的 KAPA HiFi 系列高保證聚合酶的誕生即得益于“定向進化”的強大威力。
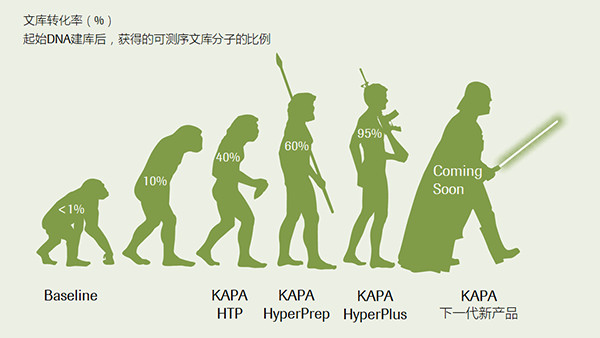
“定向進化”技術帶來的文庫轉化效率的提升。此處采用“文庫轉化率”這個關鍵指標來評估建庫的整體效率,轉化率越高,建庫效率也越高。(數據來源于羅氏診斷總部)
那么,何為“定向進化”技術呢?
簡而言之,就是開了掛的人工進化技術。無論是自然進化還是定向進化,都是特定基因的突變或重組,進而產生多樣化的蛋白質,通過自然篩選產生多樣化的生命。但自然進化和定向進化的區別就是,前者的過程是極其緩慢的、不可控的。地球經歷了40多億年才孕育出如今的文明,相比之下,人類短暫的生命只是滄海一粟,又能經歷多少等待呢?Frances Arnold給出的答案就是后者——定向進化——只爭朝夕!KAPA也正是通過這種在實驗室模擬和加速野生酶的自然進化過程,成功地將自然進化的效率提升了幾百萬倍,獲得了一系列性能優異的工程酶,包括高保真聚合酶,多重PCR聚合酶,耐受PCR抑制的聚合酶,片段化酶,連接酶,反轉錄聚合酶等等。
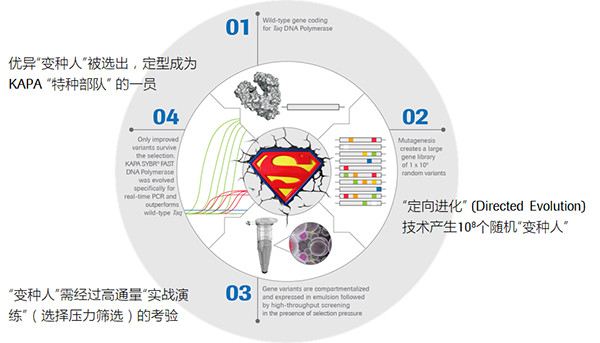
KAPA 酶的定向進化歷程
這些酶的“定向進化”往往會經歷以下幾個步驟:
· 對野生酶的編碼基因序列進行隨機變異,產生一個變異序列庫,約包含上億個變種序列。
· 變種序列被轉染到大腸桿菌的基因組中,每個單克隆都被包裹在一個微小的液滴中進行孵育和表達。由于大腸桿菌具有培養簡單、復制快、可高效表達植入的基因等特性,因而可高通量的獲得一系列按照不同變種序列翻譯而來的變種酶。
· 施加各種生存壓力(如高溫、抑制劑、低容錯等等)至反應體系,選擇性地篩選出最適應壓力環境的變種酶。
· 循環往復地重復上述步驟,每次選出相對最好的酶進行下一輪進化,來不斷優化和提升酶的特定性能,直至滿足相應的應用場景。
這些方法聽上去是不是都挺普通的?但是進化的成果卻不容小覷。接下來我們就以 KAPA HiFi 高保真聚合酶和 KAPA SYBR FAST 聚合酶為例,展示一下“定向進化”的威力吧。
高保真酶,顧名思義,就是要求聚合酶在PCR擴增中,既要保證擴增的高準確度,也能兼顧擴增效率的基本特性。高準確度往往就體現在較低的擴增錯誤率(即堿基錯配比例)和較高的擴增均一性(即擴增偏好較小,不易受到基因組GC堿基含量的改變而帶來擴增效率的改變)這兩方面。經過定向進化得來的 KAPA HiFi酶就擁有這樣的優良特性,不僅擴增產量高、片段長,而且錯誤率低和擴增偏好小,非常適合NGS應用。
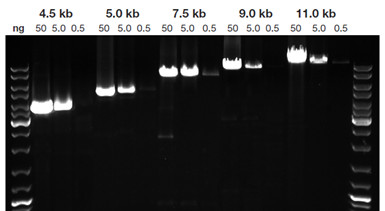
KAPA HiFi 擴增長 hgDNA 片段的表現
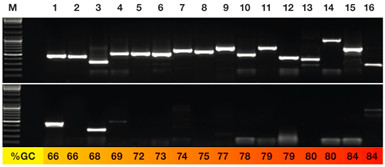
KAPA HiFi 酶(上)和 Phusion 酶(下)擴增高GC含量模板的表現
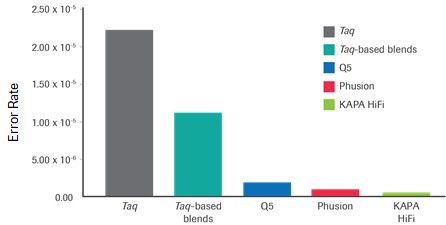
KAPA HiFi 酶的堿基錯配率及和其他高保真酶的比較
(以上數據均來源于羅氏診斷總部)
KAPA SYBR Fast 聚合酶,也顧名知其意,是一種能夠耐受高 SYBR Green 染料的聚合酶。SYBR Green 染料是一種能和雙鏈DNA結合,在特定激發光下發射熒光的染料,常被用來作為PCR的指示劑。因其易得、成本低廉和適用范圍廣的特性,已被廣泛應用在分子生物學的各個領域。但這種染料也有其缺點,那就是會對DNA聚合酶產生一定的抑制作用,造成擴增效率的下降。經過定向進化得來的 KAPA SYBR Fast 聚合酶就擁有克服這種抑制的優良特性,無論在低濃度或是高濃度的 SYBR Green 環境下,均有穩定的擴增效率表現,這種特性可幫助用戶采用更高濃度的SYBR Green染料,從而獲得更高的熒光信號,改善信噪比,降低檢出的靈敏度,增加定量的線性范圍。
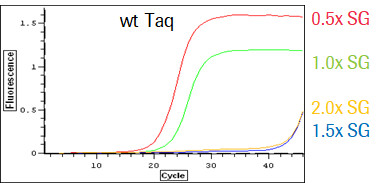
野生聚合酶在高濃度SYBR Green環境下呈現擴增抑制,以及染料濃度和熒光信號強度之間產生倒掛的問題。
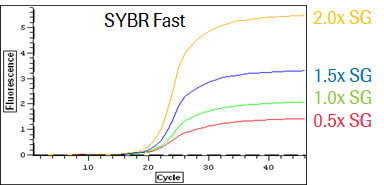

KAPA SYBR Fast 在高濃度SYBR Green環境下不僅耐受抑制,而且染料濃度和熒光信號強度呈正比。
正是有了這些通過“定向進化”得來的高性能酶,才使得 KAPA NGS樣品制備產品家族的成員從眾多同類產品中脫穎而出,成為行業普遍認可的佼佼者,無論是 KAPA HiFi 還是 KAPA SYBR Fast 都已經成為了 KAPA 文庫制備試劑盒以及文庫定量試劑盒的“靈魂”。
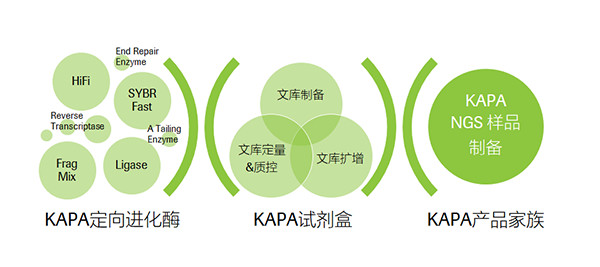
定向進化技術是KAPA產品家族的“靈魂”
高品質NGS應用酶,帶來的不僅僅是NGS應用體驗上的改善,更可幫助用戶從困難樣本中獲得高質量的NGS數據,從而克服終端應用的各種挑戰,這些困難樣本包括:
· 起始量低,如細胞游離DNA(cfDNA),循環腫瘤DNA(ctDNA),單細胞(Single Cell),穿刺樣品(Fine-needle Aspirate)和拭子樣品(Swab)等
· 降解程度高,如福爾馬林固定-石蠟包埋樣品(FFPE)等
· GC含量變化大,如微生物和植物樣品等
· 異質性高、成分復雜的樣品中檢測低頻變異或低豐度轉錄本,如腫瘤樣品等
這些挑戰背后往往伴隨的是以下樣品制備上的困難:
· 可測序分子含量少,往往不夠測序儀的上機要求。
· 攜帶關鍵信息的分子含量更少,易被無效的序列或重復的序列信息所淹沒,或因各種制備上的局限性而丟失。
· 同一樣品中的不同部分難以獲得相似的文庫轉化和擴增效率,建庫前后的差異性較大,難以還原原始樣品。
· 不同樣品的文庫混合上機測序時難以獲得“等摩爾混合”的效果,不僅達不到測序芯片的最佳成簇密度,造成通量浪費,而且也容易造成不同樣品的數據產出量不均,影響后續生物信息學分析。
KAPA采用定向進化技術,可從根本上去克服這些樣品制備上的困難:
· 高文庫轉化和擴增效率,意味著低起始量樣品、降解樣品、或者攜帶關鍵信息的序列只需較少的PCR循環數即可達到上機要求的文庫產量,不僅有效保留了關鍵信息,而且不會產生過多的重復序列,既節省了測序通量,又放大了關鍵信息。
· 高保真度和低擴增偏好,意味著更廣的目標區域覆蓋度和更均一的測序深度,不易遺漏關鍵點,也更能還原樣品本身,降低后端生信分析的難度。
· 高 SYBR Green 耐受度,意味著可提高熒光染料濃度來獲得更靈敏、更穩定的PCR檢測信號,增加定量和質量評估的準確性。
· 隨機的酶切片段化,意味著近似物理打斷的片段化效果,可滿足大通量、自動化應用的需求。
接下來就用兩個困難樣品的應用實例來佐證KAPA的實力吧。
KAPA RNA Hyper+RiboErase Kit 在 FFPE-RNA樣品制備中的應用
如今,腫瘤FFPE-RNA測序得到了越來越多的關注,因為其中攜帶的基因融合變異信息,無論在診斷還是治療層面上都非常有價值。
眾所周知,RNA相比DNA更易降解,所以RNA樣品的質量直接關乎NGS測序數據的質量。在RNA測序的各種應用中,FFPE-RNA測序無疑是“Mission Impossible”的存在,不僅是因為高度降解的緣故,完整的RNA分子含量非常有限,也是因為總RNA樣本中本身就有約90%都是無用的核糖體RNA(rRNA)序列,易干擾到有價值的變異信息的檢出。因此,FFPE-RNA樣品制備前,通常需要進行樣品質量的評估。常用的方法是用核酸分析儀對FFPE-RNA樣品進行檢測,用DV200指標來評估樣品質量的好壞,DV200即長度超過200bp的RNA序列在所有RNA序列中的占比,DV200的百分比越高,樣品的質量就越好。
我們分別測試了DV200在6%~95%之間的若干個 FFPE-RNA 樣品,通過 KAPA RNA Hyper+RiboErase Kit 建庫后的表現(這是一款可以對rRNA進行消除的高性能RNA建庫產品)。
在樣品評估階段,我們發現RNA質量對最終的文庫產量影響很大,DV200越低,最終建庫后的文庫得率也越低,接頭連接效率也越低。
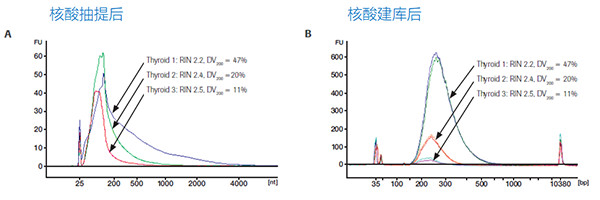
RNA質量對最終文庫得率的影響。A)3種不同質量的FFPE樣品抽提后的RNA長度分布。B)A中3種樣品各取25ng通過KAPA RNA Hyper Kit(無RiboErase富集模塊)進行建庫后的得率和長度分布,每個樣品各1個重復。不難看出,質量越好的樣品,文庫得率越高,而DV200低于11%,已經不值得再進行NGS測序。(數據來源于羅氏診斷總部)
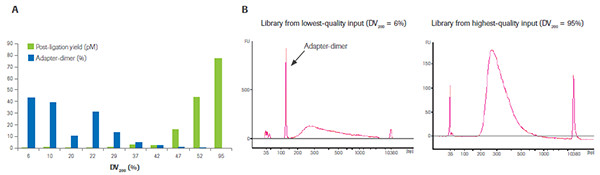
RNA質量對最終接頭連接效率的影響。A)取不同質量的FFPE-RNA樣本(DV200在6%-95%之間)各100ng,通過KAPA RNA Hyper+RiboErase Kit進行建庫后接頭連接效率的評估,藍色為接頭聚合體含量,綠色為可測序文庫含量,可見質量越低,越難獲得有效的測序文庫,大多情況下獲得的都是接頭聚合體的擴增產物,如B)中所示,而僅僅采用熒光定量的方法來評估最終文庫的產量,是非常片面的,極易導致NGS測序失敗。(數據來源于羅氏診斷總部)
基于以上認識,我們設計了如下的實驗方案,摸索了針對不同樣品質量的最優建庫流程。(數據來源于羅氏診斷總部)
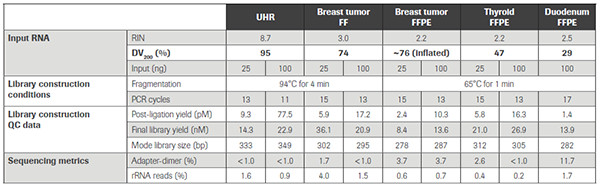
以下是 KAPA RNA Hyper+RiboErase Kit 針對不同質量樣品的建庫表現。不難看出,無論樣品質量和起始量的高低,KAPA試劑盒均表現出了較高的建庫效率。在文庫得率,上靶率,Unique轉錄本檢出數,PCR重復率、測序覆蓋均一性及重現性等關鍵指標上,均表現出色。
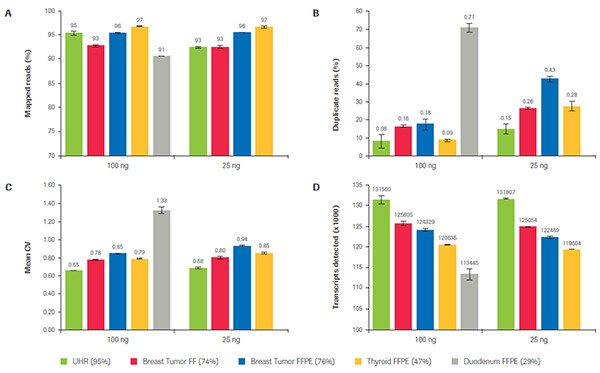
KAPA RNA Hyper+RiboErase Kit 針對不同質量FFPE-RNA樣品的建庫表現。不同顏色代表了不同質量高低的樣品,從左往右,樣品質量依次降低。在不同樣品質量和不同起始量的條件下,比較了A)Reads上靶率,B)重復Reads比例,C)覆蓋均一性,以及D)Unique Reads檢出數。KAPA均顯示出了高度的一致性和建庫效率。(數據來源于羅氏診斷總部)
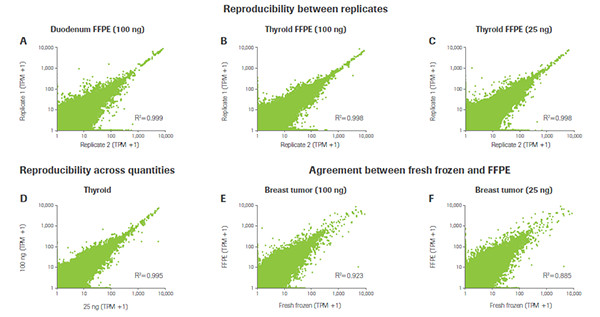
KAPA RNA Hyper+RiboErase Kit 針對不同重復之間的相關性表現。無論在什么樣品質量的條件下,KAPA在同一樣品的不同重復之間均顯示出了極高的相關性(如A、B、C所示);在同一樣品的不同起始量重復之間也顯示出了極高的相關性(如D所示);在同一類型樣品,不同RNA質量重復之間(FFPE vs. 新鮮冰凍)也均顯示出了極高的相關性(如E、F所示)(數據來源于羅氏診斷總部)
KAPA Hyper Plus Kit 在微生物樣品制備中的應用
目前,有不少科研用戶或自動化平臺用戶更傾向于酶法來代替物理打斷法進行DNA片段化。因為前者不僅對硬件的要求低,流程體驗更簡化,而且同時提高了文庫轉化率,可謂一舉兩得。酶法片段化又可分為轉座酶片段化和混合酶切片段化兩種主流的方法學。基于轉座酶片段化技術的微生物NGS文庫構建,常有三個惱人的局限性:
· 片段長度控制不佳,對 DNA 起始量敏感
· 文庫轉化效率較低
· 序列起始位點偏差大(與片段化技術相關),高挑戰區的擴增偏好明顯(高GC或AT含量區)
這些局限性限制了樣品的起始量和類型,降低了起始DNA轉換為可測序文庫的效率,以及文庫Reads的多樣性,從而影響覆蓋深度和均一性,最終影響測序數據質量和 de novo 測序的基因組完整性。
使用KAPA Hyper Plus 文庫制備試劑盒則可有效克服上述困難,相比同類產品,可獲得更高的文庫產量,片段長度適中,片段化起始位點偏差小,困難區域擴增偏好性小,覆蓋深度及均一性表現良好等特性,在3種GC含量不同的細菌樣品間的一致性好,性能更穩定。
我們設計了如下實驗方案,均按照標準流程操作。結果如下。(數據來源于羅氏診斷總部)
首先是文庫產量和片段長度分布,不難看出KAPA試劑盒在經歷同類產品相當的PCR循環數之后,可測序文庫產量要高出同類產品數倍,且片段長度適中,GC含量對產量的影響相對最小,體現了較高的建庫效率。
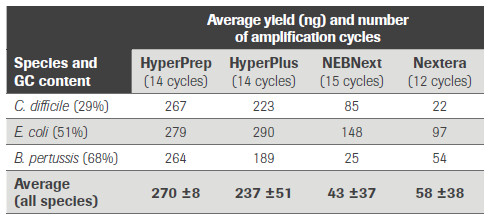
KAPA 文庫制備產品和同類產品對GC含量不同的3種微生物基因組樣品的文庫轉化效率的比較。(數據來源于羅氏診斷總部)
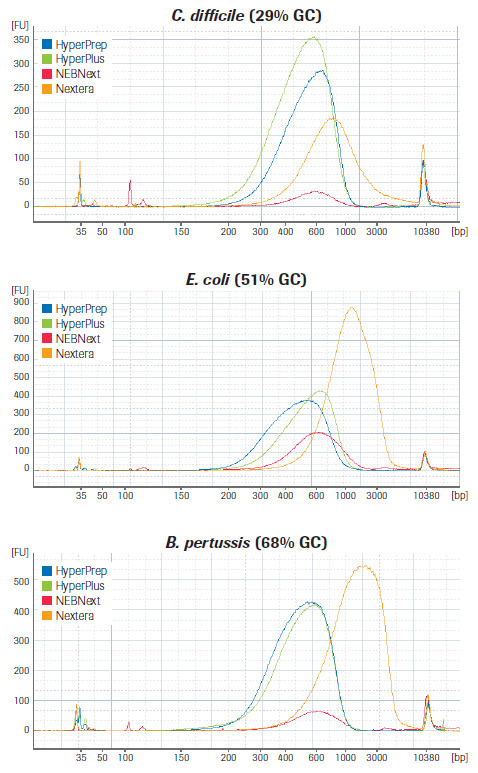
KAPA 文庫制備產品和同類產品對GC含量不同的3種微生物基因組樣品的文庫片段長度的分布比較。(數據來源于羅氏總部)
其次,在酶法片段化的偏好性上,KAPA Hyper Plus 的片段化的隨機性最接近物理打斷的效果,偏好性為同類產品最低。
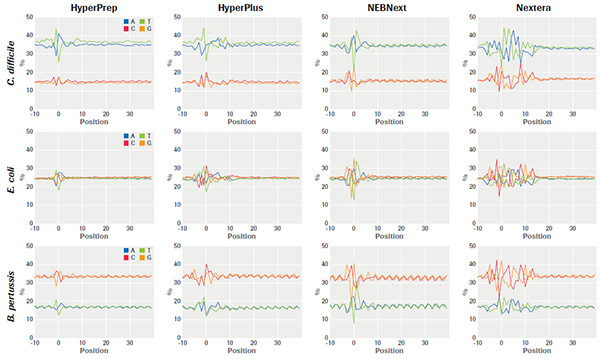
KAPA 文庫制備產品和同類產品對GC含量不同的3種微生物基因組樣品的片段化起始位點偏差比較,機械片段化+HyperPrep 偏差最小,HyperPlus 比其他轉座酶片段化產品的偏差都要小,且在GC含量不同的樣品中顯示出高度一致性。(數據來源于羅氏診斷總部)
第三,在測序均一性等指標上,KAPA 試劑盒均表現出良好的測序深度和覆蓋均一性,受GC含量的影響最小。
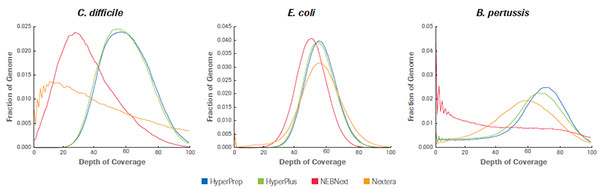
KAPA 文庫制備產品和同類產品對GC含量不同的3種微生物基因組樣品的覆蓋深度比較, HyperPrep 和 HyperPlus 比其他產品的覆蓋深度都要高,且在GC含量不同的樣品中顯示出高度一致性。(數據來源于羅氏診斷總部)
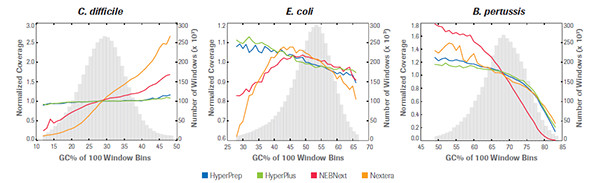
KAPA 文庫制備產品和同類產品對GC含量不同的3種微生物基因組樣品的GC偏好性比較, HyperPrep 和 HyperPlus 比其他產品在GC含量不同的樣品中均顯示出較好的無偏性,其他產品為了達到較好的AC-,GC-區域覆蓋均一性,需要消耗較多的測序通量,因而時間和成本都顯著增加。(數據來源于羅氏診斷總部)
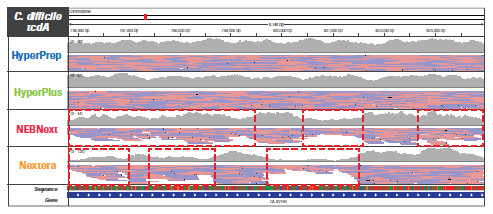
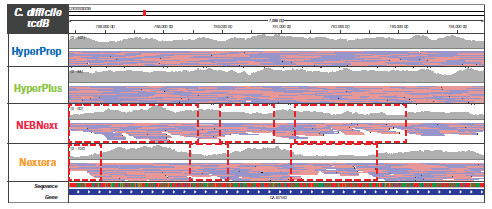
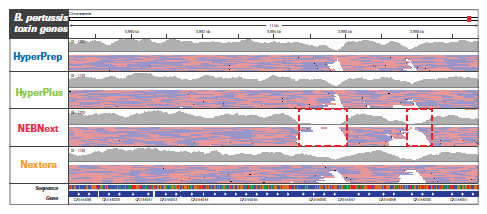
不同的文庫構建方法對基因組特定區域更局部的影響。采用 HyperPrep 和 HyperPlus,每種微生物的每個區域都實現了類似且高度均一的覆蓋度。而其他產品的比對讀數分布不均勻,尤其是AT-富集的C. difficile毒力基因。另外,其他產品在GC-富集的B. pertussis毒力基因編碼區域中有兩個明顯缺口,無讀數可用。(數據來源于羅氏總部)
最后,在de novo測序上,KAPA試劑盒也體現出了一定的優越性,具體表現在contig的數量最低,contig的最長長度和N50長度都高于同類產品,這使得后期拼接組裝更容易。
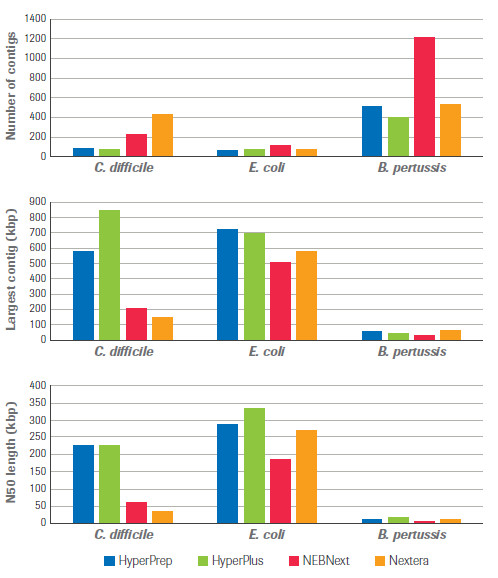
對4種文庫構建方法的關鍵 de novo 組裝指標進行比較,包括 contig 的數量,最長 contig 的長度和 N50 長度。HyperPrep 和 HyperPlus 在所有指標上均優于其他產品。(數據來源于羅氏診斷總部)
從以上實例中,你是不是已經感受到了“定向進化”的威力了呢?
心動不如行動,點擊下方的閱讀原文鏈接,去KAPA官網了解更多的應用信息,或長按以下圖片,識別二維碼,參與到KAPA試用體驗的活動中來吧!
閱讀原文鏈接:
http://lifescience.roche-diagnostics.cn/index.aspx
“愛TA 就送 TA KAPA”試用活動二維碼:





 電話
電話 主頁
主頁 留言
留言